Чрескожное чреспеченочное эндопротезирование желчных протоков: результаты применения инструментов собственной конструкции
АННАЛЫ ХИРУРГИЧЕСКОЙ ГЕПАТОЛОГИИ. 1999. Т. 4. №2 С. 42-48
В.Г. Ившин
Для профилактики миграции предлагаются различные фиксирующие приспособления и форма концов эндопротеза. Для снижения риска обструкции применяют полимеры более устойчивые к инкрустации и увеличивают диаметр эндопротеза. Однако, все это ведет к усложнению технику имплантации, повышению травматичности вмешательства, числа осложнений (до 13—51 %) и летальности до 10— 33% [4,6].
Меньше недостатков у металлических стентов. При малом диаметре доставляющего устройства они могут расширяться до 30 Р (9,9 мм). Стенты реже мигрируют и их применение дает лучшие клинические результаты (Табл. 1).
Сравнительный анализ клинических результатов применения металлических и пластиковых стентов у больных с механичкской желтухой
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||
Примечание: * - нет данных
|
||||||||||||||||||||||||||||||||||||||||||||||||
Обструкции в большинстве случаев обусловлены прорастанием опухоли через ячейки металлического стента. Однако, металлические стенты намного дороже пластиковых. В настоящее время невозможно сказать, что их применение предоставляет такие преимущества, которые оправдывали бы дополнительные затраты. В связи с этим, мы полагаем, что практическое применение металлических стентов еще не может найти должного распространения в отечественных лечебных учреждениях. Более целесообразным и экономически обоснованным нам кажется модернизация и более широкое применение пластиковых эндопротезов.
Материал и методы
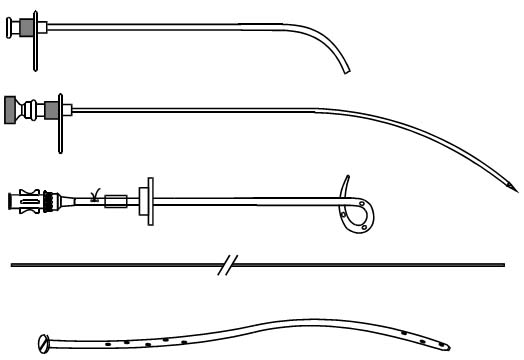
Мы, совместно с фирмой "МИТ" (г. Железнодорожный, Московской области), разработали оригинальные эндопротезы и наборы для их установки (рис. 1) (Решение о выдаче патента РФ на изобретение по заявке 96117549/14).
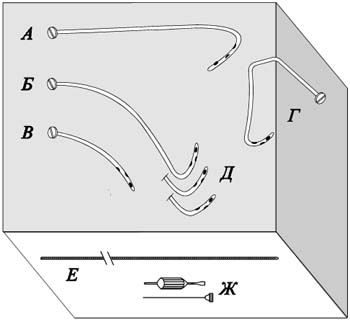
|
|
|
Рис. 1 Набор для эндопротезирования желчных протоков. Объяснение в тексте |
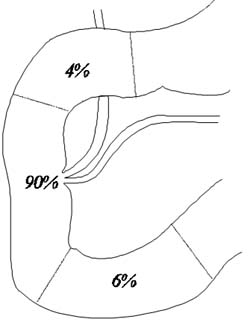
Рис. 2. Расположение фатерова сосочка в двенадцатиперстной кишке (Нидерле Б.). |
Эндопротезы имеют длину 30—35 см, наружный диаметр 12 Р (3,96 мм) и герметизирующий винт, диаметром 8 мм. В дистальной части эндопротезов имеется несколько боковых отверстий. В набор для установки эндопротеза входят металлический проводник (Рис. 1 Е) и отвертка — пробойник (Рис. 1Ж). При низком блоке общего желчного протока применяли эндопротезы, выполненые из рентгеноконтрастного полиэтилена со специальными антиинкрустирующими добавками. При имплантации через правый боковой доступ выбирали эндопротезы имеющие плавный изгиб на всем протяжении и обратный изгиб в дистальной части (Рис. 1Б). В зависимости от уровня расположения большого дуоденального сосочка в двенадцатиперстной кишке (рис. 2) применяли эндопротезы с различными вариантами кривизны дистального конца (Рис. 1Д). При расположении БДС в верхнем горизонтальном отделе двенадцатиперстной кишки применили эндопротез, имеющий односторонне направленные изгибы различных радиусов (Рис. 1А, Рис.З).
Эндопротез, устанавливаемый через левый долевой проток, имеет более сложную пространственную конфигурацию, повторяющую траекторию пункционного канала и анатомию внутри- и внепеченочных отделов билиарного дерева. При этом, проксимальнан часть эндопротеза располагается в плоскости, близкой к перпендикулярной (Рис. 1Г).
При опухолевом поражении ворот печени применяли более короткие полиэтиленовые или силиконовые эндопротезы (Рис. 1В). После имплантации их дистальный конец располагался проксимальнее сфинктера БДС.
Предложенные эндопротезы имеют низкую вероятность дислокации, а в случае закупорки могут быть легко извлечены и заменены на новый. Эндопротезирование желчных протоков с помощью указанных эндопротезов выполнили у 40 больных (25 мужчин и 15 женщин) в возрасте от 38 до 75 лет (в среднем 64,8 ± 1,39 года), находившихся на лечении в Тульской областной больнице и Тульском центре хирургии печени, желчных протоков и поджелудочной железы в течение 1995—1998 годов.
Причинами механической желтухи являлись: опухоли поджелудочной железы (25 больных), БДС (3 больных), гепатикохоледоха (2 больных), желчного пузыря (1 больной), внутрипеченочных желчных протоков (2 больных), метастазы в ворота печени (1 больной), рак желудка с прорастанием двенадцатиперстной кишки и общего желчного протока (2 больных), хронический панкреатит (1 больной). У одного больного холангиокарцинома печени развилась на фоне первичного склерозирующего холангита. У больного с хроническим панкреатитом первоначально был установлен диагноз опухоли поджелудочной железы. Однако, гистологической верификации не было, а истинный диагноз был установлен только в результате длительного последующего клинического наблюдения. Длительность желтухи до госпитализации составила 21,5 ± 2,25 суток, средняя билирубинемия 264 ± 29,5 мкмоль/л. Эндопротезирование выполняли при наличии признаков неоперабельности или крайне высоком операционном риске.
35 больным эндопротез имплантировали из правостороннего доступа, 2 — из эпигастрального. 3 больным с опухолями в области конфлюэнса выполнили раздельное протезирование протоков правой и левой долей печени. Всего было имплантировано 43 эндопротеза.
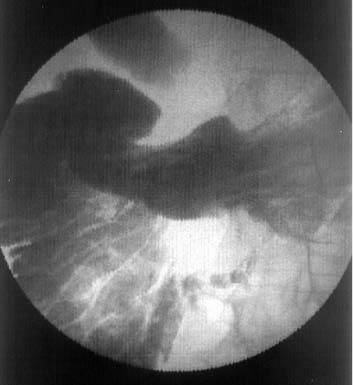
Эндопротезирование выполняли следующим образом. На первом этапе (в среднем через 3,18±0,62 суток от поступления) выполняли наружное желчеотведение методом чрескожной чреспеченочной холангиостомии. Для этого применяли оригинальные инструменты и методику, описанные нами ранее [1.2]. Через несколько суток (в среднем 8,79± 1,29 дней) выполняли полипозиционное рентгеновское исследование. При этом одновременно контрастировали билиарное дерево, желудок и двенадцатиперстную кишку. Уточняли уровень и протяженность окклюзии желчных протоков, характер поражения двенадцатиперстной кишки. При дуоденостазе, обусловленном опухолевым стенозом нижней горизонтальной части двенадцатиперстной кишки, от выполнения каких-либо дальнейших вмешательств воздерживались (Рис. 4). При сохраненной эвакуаторной функции двенадцатиперстной кишки пытались провести проводник и катетер через зону обструкции.
|
|
|
Рис. 4. Холангиограмма с контрастированием двенадцатиперстной кишки у больного раком поджелудочной железы. Верхняя горизонтальная часть двенадцатиперстной кишки смещена кпереди. Просвет нижнего горизонтального отдела двенадцатиперстной кишки стенозирован. Престенотический отдел резко расширен. Блок холедоха в супрадуоденальной части. |
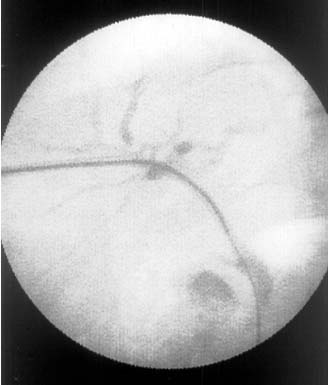
Рис. 5. Рентгенограмма больного с опухолевым блоком на уровне ворот печени во время реканализации зоны окклюзии. Во внутрипеченочный желчный проток введена металлическая канюля. Проводник проведен через зону обструкции. |
Причем, наличие контрастированного просвета двенадцатиперстной кишки служило надежным ориентиром для проведения инструментов.
При высоком блоке желчных протоков выполнение ре-канализации облегчалось применением специальных металлических канюль, располагаемых внутри катетера. Канюля препятствовала изгибам проводника в просвете протока и облегчала пространственную ориентацию над зоной окклюзии (Рис. 5).
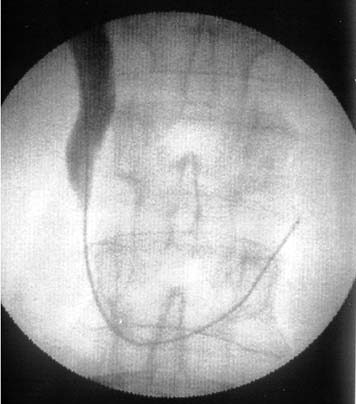
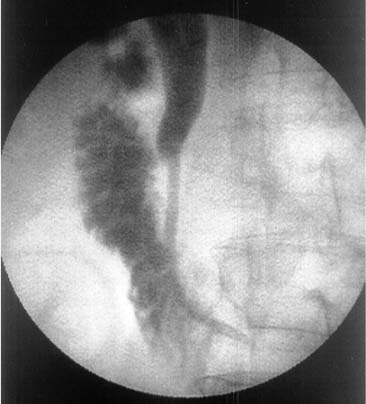
Проведение катетера через зону окклюзии удалось в 38 случаях с первой попытки, в 1 случае — со второй, в 1— с третьей, в 1-й—с восьмой. У 1 больного через зону обструкции удалось провести только проводник, попытки введения по нему катетера были безуспешны и резко болезнены. Проводник был оставлен в двенадцатиперстной кишке, а исследование временно прекращено (Рис. 6). При повторной попытке, выполненной через 1 сутки, катетер легко преодолел зону обструкции (Рис. 7). У 2 больных многократные попытки преодоления зоны обструкции были безуспешны.
|
|
|
Рис. 6. Холангиограмма больного М. Полный блок общего желчного протока в дистальной части. Через зону окклюзии удалось провести проводник. |
Рис. 7. Холангиограмма, выполненная через сутки у того же больного. В двенадцатиперстную кишку введен катетер. |
После реканализации зоны обструкции катетер фиксировали к коже, а проводник оставляли в двенадцатиперстной кишке. Наружный конец проводника располагали внутри удлинительной магистрали желчеприемника.
|
|
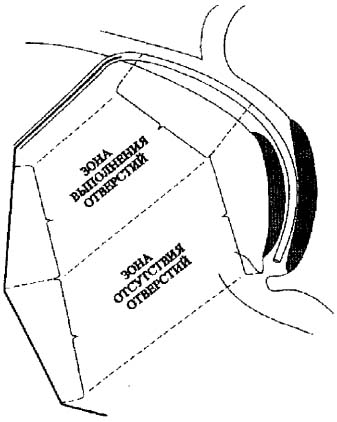
Рис. 8. Измерение расстояния от БДС до проксимальной границы блока и места выхода из внутрипеченочного желчного протока. |
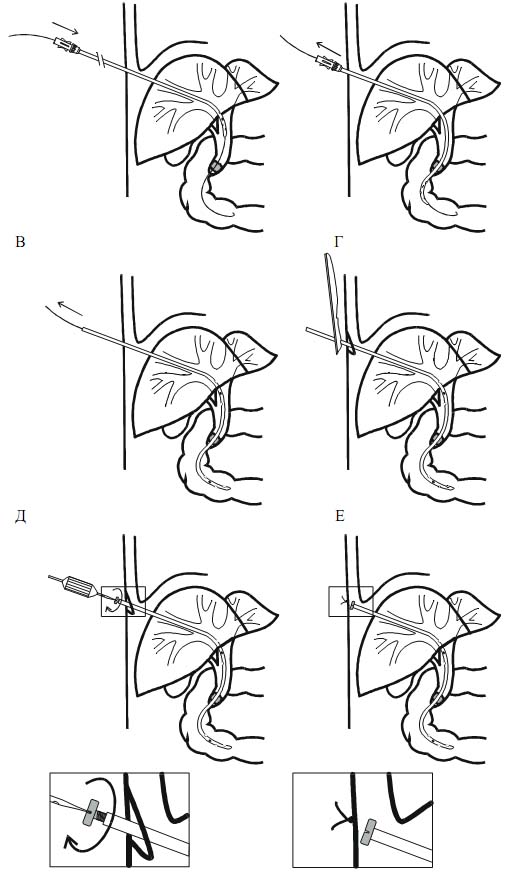
Спустя несколько дней (в среднем 4,32 ± 0,7) наружно-внутренний дренаж заменяли на эндопротез. Для этого выполняли контрольную фистулохолангиографию, и с помощью второго проводника уточняли расстояния от БДС до верхней границы блока и места выхода катетера из внутрипеченочного желчного протока (Рис.8). Выбирали наиболее подходящий эндопротез и с помощью пробойника делали дополнительные отверстия на участке, который будет располагаться проксимальнее верхней границы блока. По ранее установленному проводнику удаляли катетер и вводили эндопротез (Рис. 9).
|
|
Рис. 9. Схема эндопротезирование желчных протоков. Объяснение в тексте |
Достигали оптимального положения эндопротеза в билиарной системе и двенадцатиперстной кишке. При этом обращали особое внимание на свободное расположение дистального конца эндопротеза в просвете двенадцатиперстной кишки.
Делали небольшой разрез (2-3 см) кожи и подкожной клетчатки, после чего срезали избыточную часть эндопротеза.
С помощью винта герметизировали наружный конец эндопротеза и погружали его в подкожную клетчатку. Ушивали кожную рану.
Двум больным с высоким уровнем блока желчных протоков, которым не удалась реканализация зоны обструкции обычным путем, выполнили пункционный гепатикогастроанастомоз. Одному больному гепатикогастроанастомоз осуществили из правого бокового доступа, другому — из эпигастрального.
Для выполнения гепатикогастроанастома был сконструирован специальный набор инструментов, состоящий из жесткой канюли, имеющей дугообразный изгиб, изогнутой иглы с мандреном, фиксирующегося катетера и гибкого проводника (Рис. 10).
|
|
Рис. 10 Набор инструментов для пункционной гепатикогастростомии |
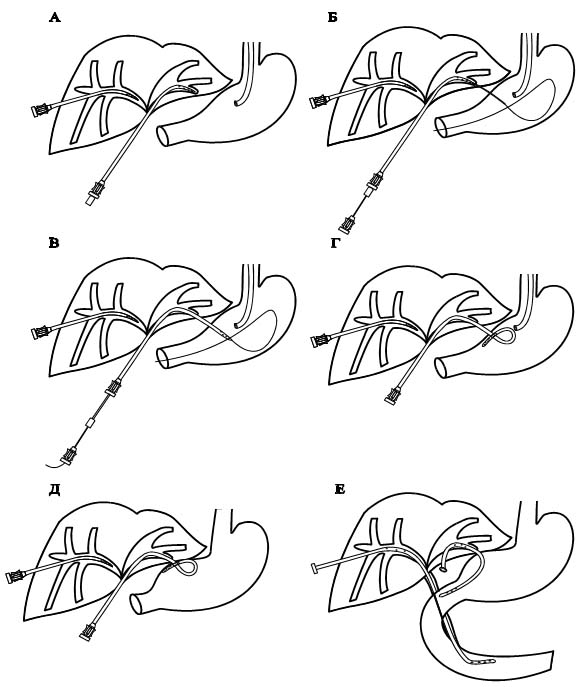
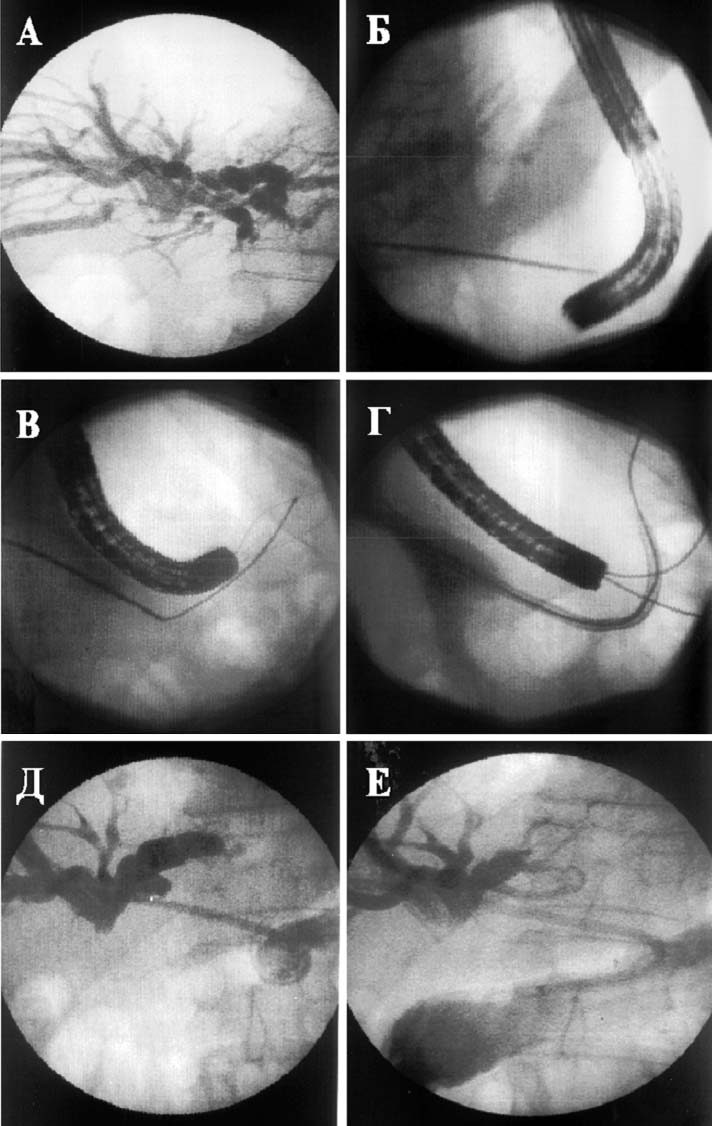
Вмешательство выполняли следующим образом. По ранее установленному катетеру в протоки левой доли вводили проводник. Катетер на проводнике заменяли на изогнутую канюлю с надетым на нее фиксирующимся катетером (Рис. 11, Рис. 12). Под рентгеноскопическим контролем устанавливали катетер и канюлю в один из сегментарных протоков, направленных к нижней поверхности печени. В желудок вводили гастроскоп и инсуфлировали воздух. При помощи полипозиционной рентгеноскопии уточняли взаимоотношение наружной канюли и желудка. В наружную канюлю вводили иглу с мандреном и выполняли пункцию желудка. При этом прокол стенки желудка контролировали визуально при помощи эндоскопа. Удаляли мандрен и проксимально глубоко вводили проводник. Проводник захватывали эндоскопической петлей, после чего в желудок вводили катетер. Удаляли проводник и канюлю. Натяжением нити добивались сворачивания дистального конца катетера, после чего легкой тракцией дренажа подтягивали желудок к нижней поверхности печени. Катетер фиксировали на коже. Через 12—14 дней после контрольной фистулохолангиографии, подтверждавшей наличие соустья между билиарной системой и желудком, катетер заменяли на эндопротез. Дистальный конец эндопротеза герметизировали и погружали в подкожную клетчатку.
|
|
Рис. 11. Схема выполнения гепатикогастроанастомоза у больного Л. А - введение изогнутой канюли с катетером в сегментарный проток левой доли; Б - пункция и введение проводника в желудок; В - введение катетера в желудок; Г - сворачивание дистального конца катетера; Д - фиксация стенки желудка к нижней поверхности печени; Е - введение эндопротезов через правый долевой проток и гепатикогастроанастомоз. |
|
|
Рис. 12. Этапы выполнения пункционного гепатикогастроанастомоза у больного Ф. |
Результаты и обсуждение
При выполнении эндопротезирования желчных протоков технических сложностей и осложнений мы не отметили.
В ближайшем послеоперационном периоде одной больной потребовалась перестановка эндопротеза: на следующие сутки была выполнена рентгеноскопия желудка, приведшая к окклюзии дистального конца эндопротеза сернокислым барием. Эндопротез извлекли, проводником удалили сернокислый барий, промыли раствором антисептика и имплантировали повторно.
У 3 больных отметили заживление послеоперационной раны вторичным натяжением. На стационарном этапе лечения умерло 3 больных. Причинами смерти у 2 явилось массивное кровотечение из острых язв желудка, у 1—полиорганная недостаточность на фоне интоксикации и кахексии.
У 37 больных отметили гладкое течение ближайшего и раннего послеоперационного периодов, (в том числе у обоих больных с гепатикогастроанастомозом). Через 8,36 ± 0,8 суток после установки эндопротеза они были выписаны на амбулаторное лечение. Среднее пребывание больных в стационаре составило 25,4 ± 1,35 суток, а средняя стоимость стационарного этапа лечения 4080 ± 284 рублей (около 680 у.е.) в ценах первого квартала 1998 года.
В отдаленном периоде у 4 больных отмечались рецидивирующие атаки холангита, которые купировались пероральным приемом доксициклина.
Замена эндопротезов потребовалась 7 (17,5 %) больным в среднем через 268 ± 107 суток после его установки. Показаниями к замене эндопротеза считали сочетание персистирующего холангита с наличием признаков билиарной гипертензии, выявляемых при контрольных ультразвуковых исследованиях. Причинами нарушения проходимости эндопротезов у 5 больных явилась инкрустация солями желчных кислот, у 1 (с гепатикогастроанастомозом) — закупорка пищевыми массами, у— 1—пролежень стенки холедоха надпапиллярным полиэтиленовым эндопротезом. Случаев миграции эндопротеза и обрастания его дистального конца опухолью не было.
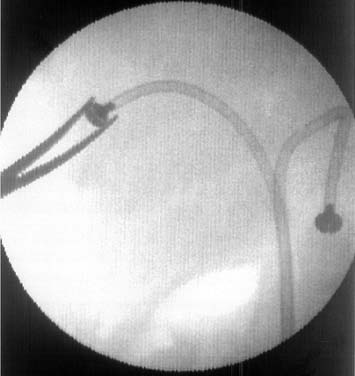
Замену эндопротеза выполняли под местной анестезией. При этом выполняли небольшой разрез кожи (1— 1,5 см) и, с помощью рентгеноскопии, захватывали герметизирующий винт хирургическим зажимом (рис. 13). Дистальный конец эндопротеза извлекали наружу, отсоединяли герметизирующий винт и вводили в желчные протоки контрастное вещество и проводник. По проводнику заменяли эндопротез на новый (рис. 14).
Простота процедуры позволила нам выполнить замену эндопротеза у 6 больных в амбулаторных условиях.
|
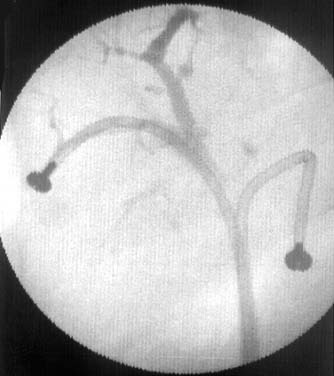
|
|
Рис. 13. Рентгенограмма больной З. во время замены эндопротеза. Наличие двух эндопротезов, установленных через желчные протоки правой и левой долей печени. |
Рис. 14. Рентгенограмма той же больной после замены эндопротеза. Следы контрастного вещества в желчных протоках. |
У 38 больных удалось проследить длительность жизни после эндопротезирования. Умерли 26 больных. Продолжительность жизни до 30 дней была у 3 больных, от 30 до 60 дней —у 5, от 60 до 3 месяцев —у 4, от 3 до 6 месяцев — у 7, более 2 лет — у 1 больного. Минимальная длительность жизни составила 12 суток, максимальная—799 суток. Средняя продолжительность жизни —140 ± 30,6 дня. К настоящему времени живы 9 больных. Средняя длительность от момента имплантации эндопротеза на 15.01.98 г. у них составляет 319 ± 98.6 суток. Продолжительность жизни больного с хроническим панкреатитом составляет 991 суток. Проходимость эндопротеза хорошая, от его удаления пациент воздерживается.
Таким образом, обобщая результаты лечения 40 больных, можно сделать заключение, что предложенные эндопротезы характеризуются простотой постановки и удаления, устойчивостью и низким процентом повторных обструкций. Инкрустация эндопротезов происходит в среднем через 9 месяцев, что намного превышает среднюю продолжительность жизни больных данной группы. Применение разработанных эндопротезов является эффективным средством внутреннего дренирования у больных с неоперабельной механической желтухой. При невозможности реканализации желчных протоков у больных с опухолевым поражением области ворот печени может быть выполнен пунк-ционный гепатикогастроанастомоз с последующим эндопротезированием.
Список литературы
1. Ившин В. Г. Устройство для чрескожного дренирования полостных образований // Хирургия. 1998. № 8. С.49—50. 2. Ившин В. Г., Якунин А. Ю., Макаров Ю. И. Чрескожные чреспеченочные диагностические и лечебные вмешательства у больных механической желтухой // Анналы хирургической гепатологии, 1996, T.I. С. 121—131.
3. Капранов С. А., Авалиани М. В., Кузнецова Н. Ф. Чреспеченочные эндобилиарные вмешательства при стриктурах желчных протоков// Анналы хирургической гепатологии, 1997, N 2, с 123—131.
4. Кузнецова Н. Ф. Чрескожное чреспеченочное эндопротезирование при механической желтухе опухолевого генеза// Автореф. дисс. к.м.н. М. 1995, 22 с.
5. Прокубовский В. И., Капранов С. А. Чреспеченочное эндопротезирование желчных протоков//Хирургия 1991, № 1, с 18—23.
6. Coons H.G., Carey P.H. Large-bore, long biliary endoprothesis (biliary stents) for improved dreinage //Radiology.l983. N. 148. P.84— »4.
7. Disk R., Platt A., Giford J. Et al., Carey-Coons percutaneous bilary endoprothesis: a three— center experience in 87 patients // Clin. »adiol.l987.N.38. p.l75—178.
8. Dooley J. S„ Disk R., George P. Et al„ Percutaneous trashepatic endoprothesis for bille duct obstructions: complications and results/ / Jastroenterology. 1984. N. 86. P. 905—909.
9. Gunter R.W., Vorwerk D. Perkutane gallenwegsdrainage // Inter vend onelle Radiologie. Editors R. W. Gunter, М. Thilen. 1996, Stuttgart-Mew York, P 472—509.
10. Kruse A. Curreni trends in the management of obstructive aundice// Gastromtestiiial and Urogenital Radiology. Edidors. Lunderquist, H.Pettersson, Merit Communications. London, 1991. P.109—133.
11. Lamraer J. Biliary Drainage Endoprotheses: Esperience with 201 Placements.// Radiology. 1986.159 N 3, P 625—629.
12. McLeod G., Annstrong D., McRoss A. et al. Management of nalignant biliary obstruction by percutaneous intraduced biliary endoptsthesis// J.R.Coll Surg. Edinburg.l986.N.31.P.210—213. 13. Morgan R„ Aadam A. Metallic Stents in the Treatment of Patients vith Malignant Biliary Obstruct) on.// Seminars in interventional radiology. Vol. 13. N. 3. P. 229—239.
14. MuellerP.R., Ferrucci J.t.,Teplick S.K., et al. Biliary stent endoрrosthesis: analysis of complications in 13 patients. // Radiology 1985, 156: 637-639.
15. Ring EJ, Schwarz W, McLean CK, Freiman DR. A simple, idwelling, biliary endoprosthesis made from commonly available catheter naterial.//ARJ 1982, 139:615—617.
Тульский центр хирургии печени, желчных путей и поджелудочной железы (зав. - Г.А. Старченко)
Percutaneous transhepatic biliary stenting: results of original instruments application
V.G. Ivshin
Tula Center of Surgery of the Liver Bile Ducts, and Pancreas. (Director - G.A. Starсhenko)
